|
Ταπείνωση σημείου πήξης 
Με την ίδια λογική, το σημείο πήξης ενός διαλύματος είναι χαμηλότερο από εκείνο του καθαρού διαλύτη. Έτσι, το θαλασσινό νερό, που είναι πλούσιο σε άλατα, δεν πήζει τόσο εύκολα όσο το νερό των λιμνών και των ποταμών.
Όμως, ας δούμε τι συμβαίνει, όταν διάλυμα NaCl ψυχθεί προοδευτικά. Κατ’ αρχάς το διάλυμα δεν πήζει στους 0 oC, όπως το καθαρό νερό, αλλά σε χαμηλότερη θερμοκρασία, οπότε σχηματίζεται πάγος, ο οποίος είναι καθαρό νερό. Μ΄ αυτό τον τρόπο το διάλυμα γίνεται πυκνότερο σε NaCl, αφού η ίδια ποσότητα άλατος μένει διαλυμένη σε λιγότερο νερό. Καθώς σχηματίζεται πάγος, η θερμοκρασία πέφτει ακόμη περισσότερο, οπότε νέες ποσότητες πάγου σχηματίζονται, αφήνοντας πίσω ολοένα και πυκνότερο κάθε φορά διάλυμα. Η πορεία αυτή συνεχίζεται μέχρις ότου το διάλυμα γίνει κορεσμένο σε NaCl. Τότε, το διάλυμα παίρνει την ελάχιστη τιμή θερμοκρασίας, η οποία ονομάζεται ευτηκτική θερμοκρασία του διαλύματος.
Η ταπείνωση του σημείου πήξης του διαλύτη εξαρτάται από τη συγκέντρωση του διαλύματος και μάλιστα ισχύει:
- Σε αραιά μοριακά διαλύματα η ταπείνωση του σ.π. είναι ανάλογη προς τη μοριακότητα κ.β. (molality) του διαλύματος.
Δηλαδή:
ΔΤf = Kf m
όπου,
ΔΤf : η ταπείνωση σ.π. του διαλύτη (σ.π. διαλύτη - σ.π. διαλύματος),
m : η μοριακότητα κατά βάρος του διαλύματος (molality)
Κf : σταθερά ταπείνωσης σ.π. ή σταθερά κρυοσκοπίας, η οποία εξαρτάται από τη φύση του διαλύτη. Όταν η μοριακότητα κατά βάρος του διαλύματος είναι 1 m, τότε η τιμή της ΔΤf είναι αριθμητικά ίση με την Κf.
Γενικά αναφέρουμε ότι οι μεταβολές στο σ.π., που προκαλούνται κατά τη διάλυση μιας ουσίας σ' ένα διαλύτη, είναι πιο σημαντικές από τις αντίστοιχες του σ.β. Για το λόγο αυτό, και επειδή το σ.π. μετράται πειραματικά με μεγαλύτερη ακρίβεια από το σ.β., η κρυοσκοπία βρίσκει πολλές εφαρμoγές.
- Κρυοσκοπία ονομάζεται η μέθοδος προσδιορισμού της σχετικής μοριακής μάζας με βάση τη μέτρηση πειραματικά του ΔΤf, εφαρμόζοντας τον παραπάνω νόμο:
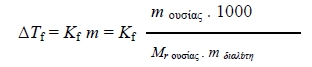
όπου,
m ουσίας : η μάζα της διαλυμένης ουσίας
Μr ουσίας : η σχετική μοριακή μάζα της διαλυμένης ουσίας και
m διαλύτη : η μάζα του διαλύτη.
|