|
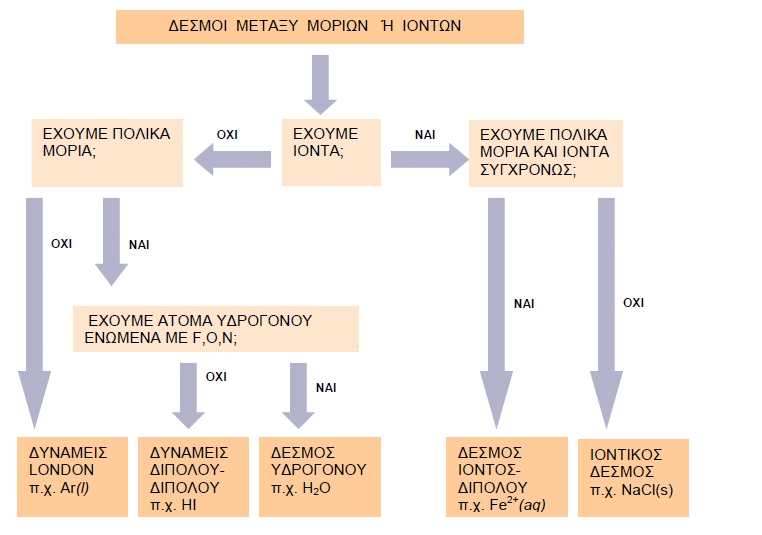
β. Δυνάμεις London και
γ. Δεσμός υδρογόνου, που αποτελεί ειδική περίπτωση δυνάμεων
διπόλου - διπόλου.
Δεσμοί Van der Waals
1. Δυνάμεις διπόλου - διπόλου
Στο κεφάλαιο του μοριακού δεσμού έχει γίνει λόγος για την πολικότητα
των μορίων. Έτσι, στο μόριο του HCl το φορτίο του κοινού ζεύγους των
ηλεκτρονίων, μέσω του οποίου γίνεται η σύνδεση των δύο ατόμων, είναι
μετατοπισμένο προς το ηλεκτραρνητικότερο άτομο του Cl με
αποτέλεσμα την εμφάνιση κέντρου αρνητικού φορτίου σ' αυτό (σύμβολο
δ-). Η μετατόπιση αυτή δημιουργεί επίσης θετικό φορτίο στο άλλο άκρο
του μορίου, που είναι το άτομο του Η (σύμβολο δ+). Το μόριο δηλαδή
του HCl είναι πολικό και συμπεριφέρεται ως ηλεκτρικό δίπολο,
χαρακτηριστικό μέγεθος του ο ποίου είναι η διπολική ροπή, μ. Όταν δύο
πολικά μόρια π.χ. μόρια HCl βρεθούν με κατάλληλο προσανατολισμό,
όπως φαίνεται στο παρακάτω σχήμα, έλκονται μεταξύ τους και
πλησιάζουν το ένα στο άλλο. Κατ΄ αυτό τον τρόπο αποκτούν μικρότερη
ενέργεια, άρα και μεγαλύτερη σταθερότητα.
 |
ΣΧΗΜΑ 1.1
Έλξη μεταξύ διπόλων μορίων. |
Γενικεύοντας, καταλήγουμε στο συμπέρασμα, ότι στα πολικά
μόρια οι διαμοριακές ελκτικές δυνάμεις είναι ηλεκτροστατικής φύσης
μεταξύ των ετερώνυμα φορτισμένων άκρων, πόλων, των μορίων. Η
ισχύς των δεσμών αυτών αυξάνει όσο αυξάνει η διπολική ροπή των
μορίων (με την προϋπόθεση τα μόρια να έχουν περίπου την ίδια μάζα και
όγκο). Eίναι εύκολο να καταλάβει κανείς, ότι όσο ισχυρότερες είναι
αυτές οι δυνάμεις, τόσο «ευκολότερα» υγροποιείται ένα αέριο σώμα,
δηλαδή τόσο μεγαλύτερο σημείο βρασμού έχει. Και ανάποδα, όσο
μικρότερες είναι οι διαμοριακές δυνάμεις, τόσο «δύσκολα» υγροποιείται
ένα αέριο. Αυτό φαίνεται και στον παρακάτω πίνακα:
ΠΙΝΑΚΑΣ 1.1 Συσχέτιση της διπολικής ροπής των μορίων με το Σ.Ζ.
| ΕΝΩΣΗ |
Μr |
μ /D |
Σ.Ζ /Κ |
| προπάνιο, CH3CH2CH3 |
44 |
0,1 |
231 |
| διμεθυλαιθέρας,CH3OCH3 |
46 |
1,3 |
248 |
| χλωρομεθάνιο, CH3Cl |
50 |
1,9 |
249 |
| ακεταλδεΰδη, CH3CHO |
44 |
2,7 |
294 |
| αιθανονιτρίλιο,CH3CN |
41 |
3,9 |
355 |
|